気体の状態変化
変数を固定してみる
理想気体を封入したピストン付きシリンダーにおいて、外部から加えた熱量を \(Q\) [J] 、外部からの仕事を \(W\) [J] 、内部エネルギーの増加分を \(ΔU\) [J] とすると、熱力学第1法則より、
\(ΔU = Q + W\) ……①
であり、さらに、気体の圧力を \(p\) [Pa] 、体積を \(V\) [m3] 、絶対温度を \(T\) [K] とすると、ボイル⋅シャルルの法則より、
\({\large\frac{pV}{T}}\) = (一定) ……②
でありますが、
2式の中の様々な変数のうち、どれを固定すると何と何が連動するか、考察してみます。
定積変化
体積が一定のまま、温度や圧力が変化する状態変化を定積変化 定積過程、等積変化、等積過程、定容変化など、いろいろな呼び名があります。 といいます。これはピストンを固定しながらシリンダーを加熱、冷却するような状態変化です。
\(V\) が一定なので、\(W = pΔV\) の \(ΔV\) が 0 であり、つまり \(W = 0\) であり、①式 \(ΔU = Q\ \color{#bbb}{+\ W}\) は
\(\boldsymbol{ΔU = Q}\)
となります。ピストンが動かないということは仕事が 0 ということであり、気体に加えられた熱は全て内部エネルギー(=分子のスピード=温度)の増加に使われます。
そして、②式 \({\large\frac{p\color{#bbb}{V}}{T}}\) = (一定) は、\(V\) が一定であるので、
\(\boldsymbol{{\large\frac{p}{T}}}\) = (一定)
となります。圧力と温度が比例するという意味です。
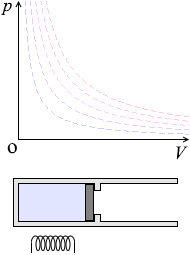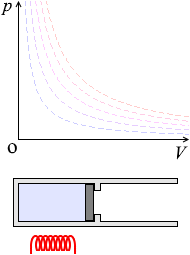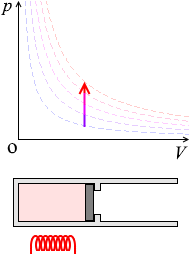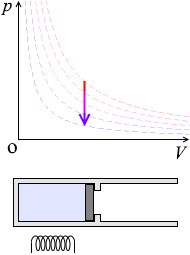 要するに、ピストンを固定して加熱すると温度と圧力が上がります。あるいは、冷却すると温度と圧力が下がります。(\(ΔU\) と \(ΔT\) は同じようなものです
\(ΔU = {\large\frac{3}{2}}\)\(nRΔT\) です。
要するに、ピストンを固定して加熱すると温度と圧力が上がります。あるいは、冷却すると温度と圧力が下がります。(\(ΔU\) と \(ΔT\) は同じようなものです
\(ΔU = {\large\frac{3}{2}}\)\(nRΔT\) です。
分子の数 \(n\) が変化しない(封入されている気体が漏れたりしない)なら
\({\large\frac{3}{2}}nR\) は定数であり、
\(ΔU\) と \(ΔT\) は実質的に同じものということになります。
)
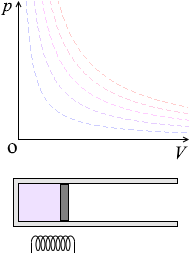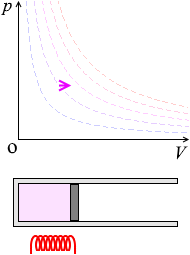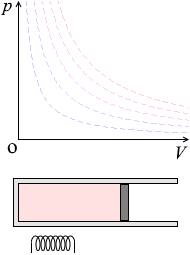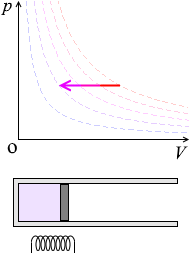
\(p\textrm{-}V\)グラフにおける定積変化の曲線は縦の線となります。圧力が上がっていくと高温側の等温曲線に移っていきます
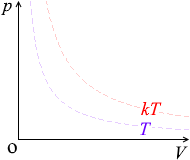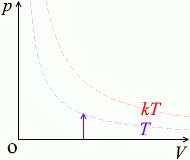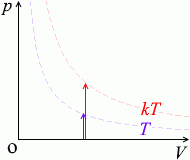
\(p\) が \(k\)倍になると \(T\) も \(k\)倍になります。\({\large\frac{p}{T}}\) =(一定)です。
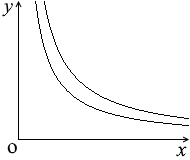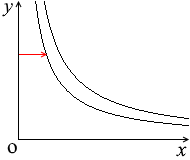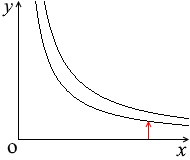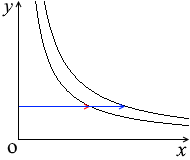 数学の直角双曲線の性質の話ですが、たとえば、
数学の直角双曲線の性質の話ですが、たとえば、
\(y={\large\frac{2}{x}}\) の曲線と \(y={\large\frac{3}{x}}\) の曲線を見比べると、どこを切っても1.5倍となっています。
。
加熱すると分子のスピードが上がり、すなわち温度が上がり、ピストンと衝突する回数が増え、圧力が上がります。
定圧変化
圧力が一定のまま、温度や体積が変化する状態変化を定圧変化
定圧過程、等圧変化、等圧過程など、いろいろな呼び名があります。
といいます。これは、ピストンを自由に動けるようにして内圧と外圧が常に等しくなるようにして加熱、冷却するような状態変化です。
シリンダーを縦にしてピストンの上に重りを載せれば圧力の大きさを自在に変えられます。(もし外気圧より低い圧力にしたければヘリウム入り風船をピストンに取り付ければいいかもしれません)
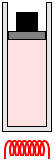
加熱( \(Q\) )すると、分子のスピード( \(ΔU ≒ ΔT\) )が上がり、圧力が上がり、ピストンを押して負 今は外部の力がした仕事を \(W\) と定義しているので、気体が膨張した場合は、仕事の正負は「負」です。もし、気体のした仕事を \(W\) と定義してあるならば仕事は「正」で、\(W = pΔV\) です。 の仕事をし( \(W = - pΔV\) )、(体積が増えて分子の衝突回数が元に戻って内圧と外圧が等しくなり)圧力が元に戻り、加熱され、温度が上がり、圧力が上がり、ピストンを押して仕事をし、圧力が元に戻り、加熱され、…、を繰り返します。
①式 \(ΔU = Q + W\) は
\(\boldsymbol{ΔU = Q - pΔV}\) (移項すると \(\boldsymbol{Q = ΔU + pΔV}\) )
となります。
②式 \({\large\frac{\color{#bbb}{p}V}{T}}\) = (一定) は、\(p\) が一定であるので、
\(\boldsymbol{{\large\frac{V}{T}}}\) = (一定)
となります。体積と温度が比例するという意味です。シャルルの法則のことです。
 ピストンを自由に動けるようにしておいて加熱すると、温度が上がり、体積が増えます。あるいは、冷却すると、温度が下がり、体積が減ります。
ピストンを自由に動けるようにしておいて加熱すると、温度が上がり、体積が増えます。あるいは、冷却すると、温度が下がり、体積が減ります。
\(p\textrm{-}V\)グラフにおける定圧変化の曲線は横の線となります。体積が増えていくと高温側の等温曲線に移っていきます
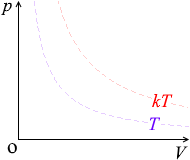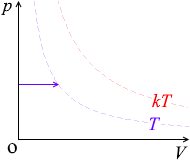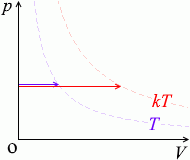 \(V\) が \(k\)倍になると \(T\) も \(k\)倍になります。
\(V\) が \(k\)倍になると \(T\) も \(k\)倍になります。
体積が増えると内部エネルギー(=分子のスピード=温度)が減りそうですが、加熱されているので温度は下がりません。ピストンを強引に引っ張って体積を極端に膨張させれば温度を下げることも可能ですが、今は前提として、内圧と外圧が等しくなるようにピストンは自由に自然に動ける状態にされています。
。
加熱すると温度(=分子スピード)が上がり、ピストンと衝突する回数が増え、ピストンを押し、体積が大きくなり、分子が往復する距離が大きくなり、衝突回数が元に戻ります(元の圧力に戻って外部の圧力と等しくなる)。
等温変化
温度が一定のまま、圧力や体積が変化する状態変化を等温変化 定温過程、定温変化、等温過程など、いろいろな呼び名があります。 といいます。これは、熱を伝えやすい素材でできたシリンダーにおいて、ゆっくりとピストンを動かして常に内部と外部の温度を等しくしておくような状態変化です。
\(T\) が変化しないので \(ΔU = 0\) であり 上の方でも説明しましたが、\(ΔU = {\large\frac{3}{2}}\)\(nRΔT\) でありますから、\(ΔT = 0\) のとき \(ΔU = 0\) です。 、①式 \({\color{#bbb}{ΔU}} = Q + W\) は
\(\boldsymbol{0 = Q + W}\)
となります。膨張させると外部から熱を奪い(\(W < 0\)、\(Q > 0\) 等温膨張)、圧縮すると外部へ熱を放出します(\(W > 0\)、\(Q < 0\) 等温圧縮)。
②式 \({\large\frac{pV}{\color{#bbb}{T}}}\) = (一定) は、\(T\) が一定であるので、
\(\boldsymbol{pV}\) = (一定)
となります。圧力と体積が反比例するという意味です。ボイルの法則のことです。
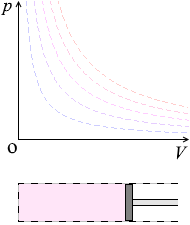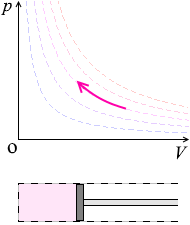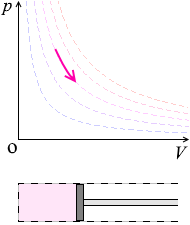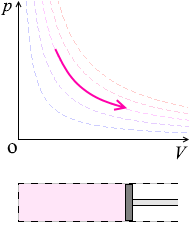 温度を一定に保ちながら、ピストンを引くと圧力が下がります。ピストンを押し込むと圧力が上がります。
温度を一定に保ちながら、ピストンを引くと圧力が下がります。ピストンを押し込むと圧力が上がります。
\(p\textrm{-}V\)グラフにおける等温変化の曲線は等温曲線に沿った線となります。
温度(=分子スピード)を一定に保ちながら体積を大きくすると、ピストンと衝突する回数が減り、圧力が下がります。体積を小さくすると、ピストンと衝突する回数が増え、圧力が上がります。
断熱変化
熱の出入り無しで温度や圧力や体積が変化する状態変化を断熱変化 断熱過程ということもあります といいます。これは、断熱素材でできたシリンダーにおいてピストンを動かすような状態変化です。
\(Q\) が 0 なので、①式 \(ΔU = {\color{#bbb}{Q\ +}}\ W\) は
\(\boldsymbol{ΔU = W}\)
となります。膨張させると温度が下がり(\(W < 0\)、\(ΔU < 0\) 断熱膨張)、圧縮すると温度が上がります(\(W > 0\)、\(ΔU > 0\) 断熱圧縮)。
②式 \({\large\frac{pV}{T}}\) = (一定) は、一定となる変数は無いのでそのまま
\(\boldsymbol{{\large\frac{pV}{T}}}\) = (一定)
です。
 断熱された状態で、
断熱された状態で、
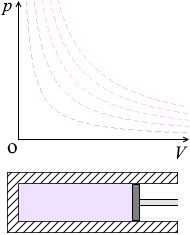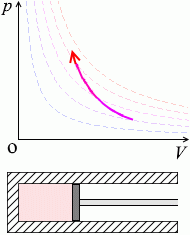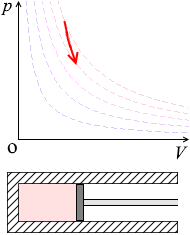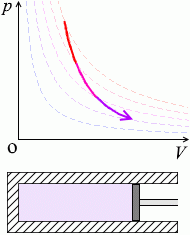
ピストンを引く(=体積を大きくする=負の仕事をする)と温度と圧力が下がります。
ピストンを押す(=体積を小さくする=正の仕事をする)と温度と圧力が上がります。
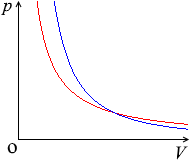
\(p\textrm{-}V\)グラフにおける断熱変化の曲線は等温曲線を次々にまたぎます。
ピストンを外へ引くと、分子のスピードが落ち(=温度が下がる=\(U\)が減少する)、圧力も小さくなり、
ピストンを内へ押すと、分子のスピードが増し(=温度が上がる=\(U\)が増加する)、圧力も大きくなります。